Det skjer ein revolusjon på labben – genredigering for alle!
Stipendiat Pawel Borowicz kuttar i DNA for å lære meir om immunforsvaret.

Denne artikkelen er eldre enn 1 år gamal. Det betyr at noko av informasjonen kan vere utdatert.
– Dette er den genetiske revolusjonen, men folk flest veit ikkje kva det er, seier stipendiat Pawel Borowicz.
Han snakkar om CRISPR, ein ny teknologi for å fjerne, endre eller sette inn gen i levande celler. Gjennombrotet kom i 2012, og har utvikla seg i rekordfart dei siste åra. 27-åringen ved Institutt for medisinske basalfag ved Universitetet i Oslo er ein av doktorgradskandiatane som har kasta seg på bølgja.
– Eg har nytta CRISPR for å endre på eitt enkelt gen i immuncellene vi jobbar med, fortel Borowicz.
Han arbeider med å kartlegge kvifor immunforsvaret angrip vanlege, friske celler. Det er det som skjer hjå pasientar med MS (multippel sklerose), ein såkalla autoimmun sjukdom. Målet til Borowicz er å utvikle legemiddel som hindrar overaktivering av immuncellene.

Pawel Borowicz arbeider i forskingsgruppa til Anne Spurkland ved medisinsk fakultet på UiO. Foto: Åsmund H. Eikenes
Ei saks, ein guide og hjelp til reparasjon
CRISPR-teknologien baserer seg på to delar: eit enzym som kuttar i DNAet, og ein guide som fortel kvar enzymet skal utføre kuttet. Saman utgjer dei ein enkel, billig og svært effektiv måte å kutte DNA i levande celler.
– Vi utnyttar at cella vil prøve å reparere skaden, forklarar Borowicz.
For å lure cellene har Borowicz gitt dei eit stykke DNA som dei kan bruke som hjelp til reparasjonsprosessen. I det ekstra DNAet har han lagt inn mutasjonar som han ønsker å studere.
Cellene oppdagar kuttet, og brukar det ekstra DNAet som oppskrift på korleis det reparerte DNAet skal sjå ut. Resultatet vert at cella reparerer kuttet, men står att med endringane som Borowicz har planlagt.
LES OGSÅ: Kvinne døydde av superbakterie
Spennande og utfordrande
Resultata så langt viser at ulike mutasjonar har ulik effekt. Ein mutasjon gjer at immuncellene reagerer alt for kraftig, medan ein annan mutasjon gjer at cellene ikkje vert aktivert i det heile.
– Kanskje kan vi nytte resultata for å justere immunresponsen hos pasientar i framtida, seier han.
Borowicz fortel også at det er eksperimentelle utfordringar han må ta omsyn til og tenke på.
– Variasjon og uventa bieffektar av CRISPR gjer at cellene ikkje er like kvarandre. Då er det ikkje alltid så lett å vite om resultata eg får er grunna skilnader som eg har gitt cellene, eller skilnader som dei har fått av seg sjølv, seier han.
LES OGSÅ: Roboten Dyret har lært seg sjølv å gå.
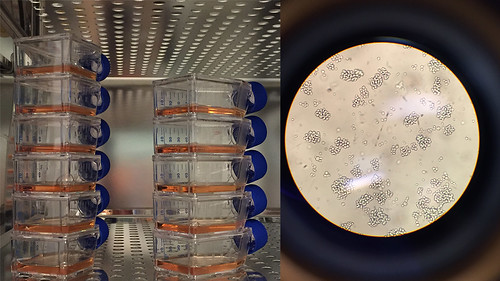
Mellom eksperimenta bur immuncellene i eit varmeskap (til venstre) som held 37 grader, og cellene får næring frå ei oransjerosa væske. I mikroskopet ser cellene ut som små klinkekuler, klumpa saman i grupper (til høgre). Foto: Åsmund H. Eikenes
Revolusjonerande teknologi
 I forskingsgruppa til Ragnhild Eskeland (foto) ved Institutt for biovitskap ved Universitetet i Oslo nyttar dei CRISPR til å studere gen som det ikkje har vore så lett å studere før.
I forskingsgruppa til Ragnhild Eskeland (foto) ved Institutt for biovitskap ved Universitetet i Oslo nyttar dei CRISPR til å studere gen som det ikkje har vore så lett å studere før.
– På laboratoriet er dette ein revolusjonerande teknikk. Den er billig, enkel og kan gi oss svar i forskninga vår i løpet av få veker, skriv Eskeland i ein epost til Framtida.no
Ho trekk også fram at teknologien stadig er i utvikling, men at ikkje alle typar eksperiment er moglege å utføre endå, sjølv med CRISPR.
– Den største avgrensinga i dag er at me ikkje kan nå alle biter av arvematrialet vårt. Det vil seie at me ikkje nødvendigvis får til å endre eller redigere kva me vil, skriv ho.
Medisinsk forsking
Eskeland er entusiastisk for framtida innan genredigering.
– CRISPR er spådd stor framgang i biologisk og medisinsk forskning, konkluderer ho.
Dei aller første forsøka med CRISPR-modifiserte immunceller i behandling har allereie blitt sett igang, både i USA og i Kina. I første omgang får nokre få kreftpasientar teste om dei toler dei genredigerte cellene. Dersom alt går bra, vil fleire pasientar kunne få prøve behandlinga.
Det er også venta at CRISPR kjem til å bli eit viktig verktøy for å kurere uvanlege genetiske sjukdommar, til å genmodifisere matplanter og husdyr, og til å sette ein stoppar for myggen som fraktar Zika-viruset. HER kan du sjå eit føredrag om CRISPR av Ragnhild Eskeland.
Dei teknologiske moglegheitene er mangfaldige. Revolusjonen skjer no.
Fakta
Pawel Borowicz, 27 år
PhD-stipendtiat ved IMB, MedFak, UiO
Prosjekt: Genredigering av immunceller
Dings: Gensaksa CRISPR